Komarowate, komary (Culicidae) – występująca na całym świecie rodzina owadów (nadrodzina Culicoidea) z rzędu muchówek.
Znanych jest ponad 40 rodzajów i ok. 3,5 tys. gatunków komarów. Dawniej
do komarowatych zaliczano także jako podrodziny: Chaoborinae (obecnie
rodzina Chaoboridae) i Dixinae (obecnie rodzina Dixidae).
 |
Systematyka
Rodzina komarowatych dzieli się na następujące podrodziny i rodzaje:
- Podrodzina Anophelinae
- Podrodzina Culicinae
- Aedeomyia
- Aedes (czasem wydzielany jest rodzaj Ochlerotatus).
- Armigeres
- Ayurakitia
- Coquillettidia
- Culex
- Culiseta
- Deinocerites
- Eretmapodites
- Ficalbia
- Galindomyia
- Haemagogus
- Heizmannia
- Hodgesia
- Isostomyia
- Johnbelkinia
- Limatus
- Lutzia
- Malaya
- Mansonia
- Maorigoeldia
- Mimomyia
- Onirion
- Opifex
- Orthopodomyia
- Psorophora
- Runchomyia
- Sabethes
- Shannoniana
- Topomyia
- Trichoprosopon
- Tripteroides
- Udaya
- Uranotaenia
- Verrallina
- Wyeomyia
- Zeugnomyia
- Podrodzina Toxorhynchitinae
Budowa ciała
Dorosłe komary mają aparat gębowy kłująco-ssący. Składa się od z wydłużonych: warg (górnej i dolnej), żuwaczki, podgębia oraz szczęk I pary.

Fizjologia
Samice tych owadów ssą krew zwierząt stałocieplnych (ssaków lub gadów) a niektóre owadów, ponieważ do powstania jaj w jajnikach wymagają odżywiania się krwią określonych gatunków zwierząt. Natomiast samce żywią się nektarem kwiatów.
Samice komarów przywabia zwiększone stężenie dwutlenku węgla w wydychanym powietrzu oraz kwas mlekowy i inne składniki potu.
Posługują się też termodetekcją, co sprawia, że w przypadku ludzi
bardziej narażeni na ukąszenia komarów są młodzi mężczyźni, dzieci i
kobiety w okresie owulacji.
Badania wykazały że receptory Anopheles gambiae (wprowadzony do mutanta muszki owocowej) reagują na 4-metylofenol oraz 1-okten-3-ol. Jeden rodzaj receptora reaguje na jedne lub niewielką liczbę związków chemicznych.
Samica po przyłożeniu kłujki do ciała zwierzęcia puszcza w ruch
szczęki kształtu lancetu zaopatrzonego w haczyki. Ruchy szczęk w górę i w
dół powodują przecięcie skóry, następnie do rany zostaje wstrzyknięta
kropelka śliny,
która ma zapobiec krzepnięciu krwi. Samica odlatuje dopiero wtedy, gdy
wypełni żołądek krwią ofiary. Ślina samicy zawiera substancję chemiczną,
podrażniającą skórę, może także dochodzić do reakcji alergicznej.
Dlatego po ukłuciu skóra czerwienieje, puchnie i swędzi.
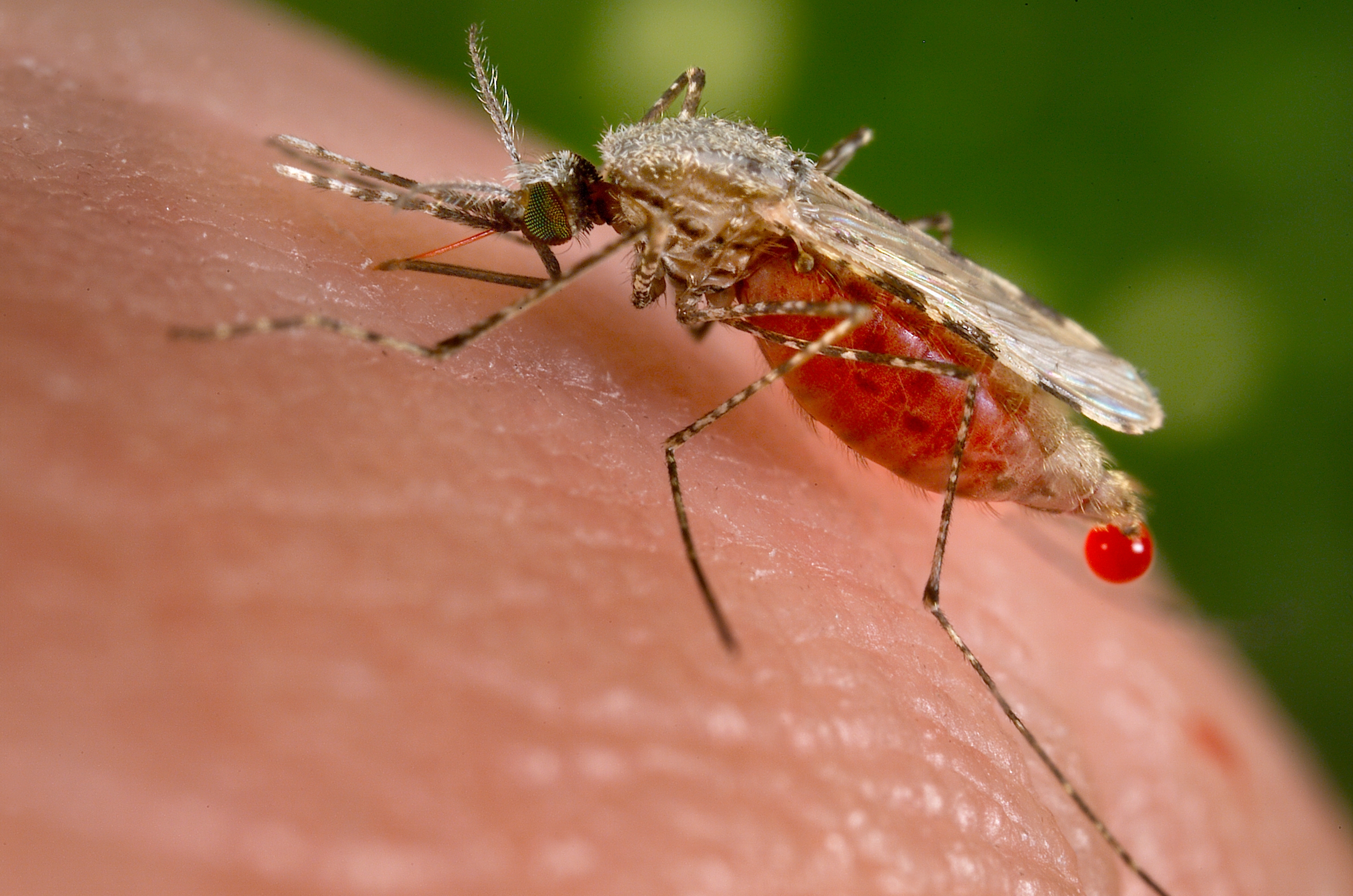
Tryb życia
Larwy rozwijają się w środowisku wodnym. Osobniki dorosłe latają
wieczorami w dużych chmarach nad podmokłymi łąkami, w pobliżu jezior,
stawów i rzek. Jedne gatunki wybierają zacienione przybrzeża, inne znowu
oświetlone, wolne przestrzenie wodne.
W niektórych przypadkach jaja nie rozwijają się, o ile nie przejdą
przez okres chłodu i nie znajdują się w środowisku wilgotnym przez
pewien okres. Jaja – zwężone na jednym końcu – składane są na
powierzchni wody tak blisko siebie, że woda nie może dostać się między
nie. Po pewnym czasie wylęgają się larwy. Oddychają one wystawiając ponad powierzchnię wody specjalną rurkę, w którą zaopatrzony jest odwłok.
Położenie, jakie zajmują larwy w wodzie, jest charakterystyczne dla
danego gatunku. Larwy pospolitego komara brzęczącego wiszą głową w dół,
natomiast larwy widliszka układają się poziomo pod powierzchnią wody.
Larwy komarów są bardzo płochliwe i zaniepokojone szybko nurkują. Żywią
się na ogół rozkładającą się materią organiczną i tylko niektóre gatunki
są drapieżcami. Poczwarki komarów, w przeciwieństwie do poczwarek innych owadów, są bardzo ruchliwe.
Tempo rozwoju komarów jest bardzo różne – jedne rozmnażają się w
ciągu kilku dni, inne zaś znacznie dłużej i rozwija się wtedy tylko
jedno pokolenie w ciągu roku.

Rozmieszczenie geograficzne
Komarowate występują od Arktyki po strefę międzyzwrotnikową.
W związku ze zmianami klimatycznymi zasięg występowania komarów ze
strefy tropikalnej rozszerza się na północ, co sprawia, że w Europie
(zwłaszcza południowej) rośnie zagrożenie chorobami przenoszonymi przez
te gatunki.
W Polsce występuje 47 gatunków przedstawicieli tej rodziny.
W niektórych latach i na niektórych terenach ich występowanie może
osiągnąć nasilenie plagowe, co zwiększa prawdopodobieństwo przenoszenia
chorób drogą krwi. Na niektórych terenach (np. po okresie powodzi)
wdrożono programy zwalczania plagowego występowania komarów.
W Polsce (i w Europie), pospolity jest:
- komar brzęczący (Culex pipiens), z dużymi przezroczystymi skrzydłami i dwiema podłużnymi pręgami na żółtobrunatnym tułowiu. Ma on liczne rasy biologiczne, uważane przez niektórych za odrębne gatunki. Rasy te wykazują wybiórczość w stosunku do żywicieli. Np. jedna z nich atakuje tylko ptaki, inna – tylko ludzi.
- Theobaldia annulata z białymi i brunatnymi pierścieniami na nogach oraz 3-5 brunatnymi plamami na skrzydłach. Samica składa jaja wiosną w wodach stojących, przede wszystkim silnie zanieczyszczonych. Po 2-4 dniach wylęgają się larwy długości 8 mm, silnie owłosione. Ruchliwa poczwarka – następne stadium rozwojowe komara – ma maczugowaty, rozszerzony tułów zaopatrzony z przodu w dwie rurki oddechowe.
- Inne gatunki wystęujące w Polsce to m.in. komar widliszek (Anopheles maculipennis), Anopheles atroparvus, Anopheles messeae, Anopheles claviger i Anopheles plumbeus.
Niektóre komary tropikalne
- Anopheles gambiae – gatunek roznoszący malarię.
- Aedes aegypti występuje na obszarze pomiędzy 42° szerokości północnej, a 40° szerokości południowej. Ma on ponad 4 mm długości i grzbietową stroną tułowia z rysunkiem w kształcie liry. Samice składają po 40-150 jaj odpornych na wysychanie. Mogą one kilka miesięcy pozostawać poza wodą. Rozwój odbywa się już w niewielkiej ilości wody mieszczącej się w dziupli drzewa, czy nawet w skorupie ślimaka. W dogodnych warunkach rozwój trwa zaledwie kilkanaście dni. Aedes aegypti prowadzi dzienny tryb życia, może jednak atakować ludzi również i w nocy. Komar ten jest przenosicielem żółtej febry, dengi, tularemii, zapalenia opon mózgowo-rdzeniowych.
- Anopheles mosquito i inne komary z tego rodzaju przenoszą malarię i filariozę.
- Stegomia calopus przenosi podobnie jak Aedes aegypti żółtą febrę.
- Phlebotomus papatasii przenosi podobnie jak Aedes aegypti gorączkę Denga.
Ekologia
Larwami owadów żywią się: wodne owady, ryby oraz płazy. Dorosłymi osobnikami żywią się owady (np. ważki) i ptaki (np. jaskółki).
Choroby roznoszone przez komary to m.in.:
- malaria
- żółta febra
- denga
- filariozy
- zapalenie opon mózgowo-rdzeniowych (West Nile virus)
- gorączka doliny Rift
Malaria, zimnica (łac. malaria, plasmodiosis, dawna nazwa febra z łac. febris = gorączka, także paludyzm) – ostra lub przewlekła tropikalna choroba pasożytnicza, której różne postacie wywoływane są przez jeden lub więcej z pięciu gatunków jednokomórkowego pierwotniaka z rodzaju Plasmodium rotium
- zarodźca ruchliwego (Plasmodium vivax),
- zarodźca pasmowego (Plasmodium malariae),
- zarodźca sierpowatego (Plasmodium falciparum),
- zarodźca owalnego (Plasmodium ovale),
- zarodźca małpiego (Plasmodium knowlesi)
Wyniki najnowszych badań wykazały, że występujący w Azji
południowo-wschodniej zarodziec małpi, który jak wcześniej sądzono jest
chorobotwórczy przede wszystkim dla małp, może także prowadzić do
zakażeń u człowieka. Jego cechy podobne są do zarodźca malarycznego, ale przebieg zachorowania jest ciężki i zbliżony do zarodźca sierpowatego.
U człowieka najczęściej dochodzi do zakażeń zarodźcem ruchliwym i
sierpowatym, przy czym ten ostatni powoduje najcięższą postać choroby i
najczęściej prowadzi do zgonu.
Inne gatunki z rodzaju Plasmodium zarażają zwierzęta.
Wektorem malarii przenoszącym ją między osobami chorymi i zdrowymi są samice komarów z rodzaju Anopheles.
Jest to najczęstsza na świecie choroba zakaźna, na którą co roku zapada ponad 220 mln osób, a umiera 1-3 mln (są to głównie dzieci poniżej 5 roku życia z Czarnej Afryki).
Zachorowania poza terenami tropikalnymi i subtropikalnymi endemicznego
występowania tej choroby spotykane są u osób powracających z tych
regionów, a także sporadycznie w pobliżu lotnisk i portów, gdzie zostają
zawleczone komary z rodzaju Anopheles.
Epidemiologia
Malaria występuje w ponad stu krajach strefy tropikalnej i
subtropikalnej; narażonych na zachorowanie jest około 1 miliard ludzi.
Zarodźce wymagają do pełnego cyklu rozwojowego 2 żywicieli:
człowieka, który jest żywicielem pośrednim (dochodzi w nim do
rozmnażania bezpłciowego pierwotniaka) i komara z rodzaju Anopheles,
który jest żywicielem ostatecznym (w nim zachodzi rozmnażanie płciowe).
To zakażeni ludzie są rezerwuarem czynnika chorobotwórczego – zarodźca
malarycznego. Wektorem malarii jest ok. 80 różnych gatunków komarów z rodzaju Anopheles (m.in. widliszek).
Do zakażenia dochodzi, kiedy żywiące się krwią ludzką zakażone samice komarów z rodzaju Anopheles wraz ze śliną do organizmu człowieka wprowadzają sporozoity zarodźca. Do zakażenia może dochodzić także przez transfuzje krwi, zakażone igły i strzykawki oraz z matki na dziecko przez łożysko. Gametocyty
od osoby chorującej na malarię dostają się do organizmu samicy komara,
gdzie w ciągu 8–35 dni przechodzą cykl rozwojowy, w przebiegu którego
powstają sporozoity. Przy ukąszeniu komara sporozoity dostają się do
krwi osoby zdrowej.
Występowanie zimnicy zależy od zasięgu występowania komarów przenoszących pasożyta, od zasięgu występowania Plasmodium,
a te zależne są od złożonych czynników środowiskowych, biologicznych i
społeczno-politycznych, a także od zapoczątkowanego przez WHO w 1953 roku programu masowego zwalczania malarii.
Ze względu na korzystne dla komarów Anopheles warunki rozwoju do rozprzestrzeniania się malarii dochodzi przede wszystkim w rejonach, gdzie temperatura powietrza wynosi 16-33 °C, a średnia wilgotność
względna wynosi powyżej 60%. W temperaturze powietrza poniżej 10 °C
larwy komarów nie rozwijają się, a przy temperaturach 10-16 °C rozwijają
się wolniej i wykazują mniejszą żywotność. Ze względu na niższą
temperaturę i wilgotność powietrza do zakażeń malarią rzadko dochodzi na
wysokościach powyżej 2000–2500 m n.p.m.
Samice komarów pobierają pokarm od zmierzchu do świtu, a miejsca ich
rozmnażania znajdują się głównie w rejonach wiejskich. Chociaż w
niektórych krajach ryzyko zachorowania w miastach jest praktycznie
bardzo małe, to w np. Afryce jest całkiem możliwe.
U dużej części Afrykanów występuje odporność na zakażenia P. vivax, co jest spowodowane tym, że ich erytrocyty nie posiadają grupy krwi Duffy,
która jest konieczna do zapoczątkowania ich inwazji przez ten gatunek
zarodźca. Rozwój zarodźców w erytrocytach jest także utrudniony u
pacjentów z hemoglobiną S, hemoglobiną C, hemoglobiną E, talasemią, niedoborem dehydrogenazy glukozo-6-fosforanowej i niektórymi typami owalocytozy.
Uodpornienie na malarię utrzymuje się po przechorowaniu, ale nie jest
ono stałe i może dochodzić do ponownych zakażeń, lecz już nie o ostrym
przebiegu. Po opuszczeniu strefy malarycznej odporność na malarię
zanika. W rejonach wysokiej zachorowalności infekcje u dzieci są
powszechne i powodują wysoką śmiertelność, lecz u osób dorosłych wytwarza się odporność.
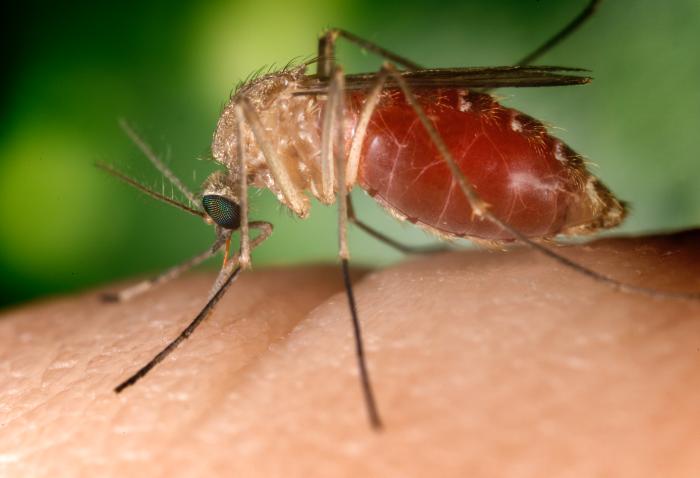
Oporność P. falciparum na leki
Poważnym problemem, przy odległej perspektywie uzyskania szczepionki
przeciw malarii, jest wystąpienie i rozprzestrzenianie się oporności
zarodźców na powszechnie stosowane leki przeciwmalaryczne – szczególnie chlorochinę.
Oporność na chlorochinę stwierdzono po raz pierwszy pod koniec lat
50. XX wieku w Kolumbii i Tajlandii. Następnie oporność stwierdzano
także w innych krajach Ameryki Południowej i południowo-wschodniej Azji.
Sytuacja stała się jeszcze bardziej poważna po stwierdzeniu
występowania oporności także w Afryce (po raz pierwszy w Kenii w 1979
r.). W następnych latach stwierdzono rozprzestrzenianie się oporności
najpierw w Afryce wschodniej, potem w całej Afryce subsaharyjskiej.
Ustalono, że oporność P. falciparum na chlorochininę i inne środki przeciwmalaryczne jest wywoływana przez mutację jednego genu (pfcrt).
Etiologia
 | |
| Cykl życiowy Plasmodium. |
Malaria jest wywoływana przez pierwotniaki z rodzaju Plasmodium . U człowieka są to cztery gatunki: P. falciparum, P. malariae, P. ovale i P. vivax. P. vivax jest najczęstszym czynnikiem etiologicznym malarii w skali światowej, odpowiadając za około 80% zachorowań. Jednak P. falciparum uważany jest za istotniejszy patogen, odpowiedzialny za tylko 15% zachorowań, ale aż 90% zgonów. Pasożytnicze gatunki z rodzaju Plasmodium zarażają też ptaki, gady, małpy i gryzonie. Udokumentowano przypadki zarażeń człowieka gatunkami typowo wywołującymi chorobę u małp, mianowicie P. knowlesi, P. inui, P. cynomolgi, P. simiovale, P. brazilianum, P. schwetzi i P. simium; znaczenie epidemiologiczne tych infekcji jest jednak bardzo ograniczone. Ptasia zimnica może być śmiertelna dla kur i indyków, ale nie przyczynia się do ekonomicznych strat u hodujących te ptaki. Jej zawleczenie na Hawaje przyczyniło się jednak do poważnego zagrożenia występującej tam endemicznej awifauny.
Cykl rozwojowy zarodźca u człowieka
W cyklu rozwojowym zarodźców występuje 2 żywicieli:
- żywiciel ostateczny – komar z rodzaju Anopheles,
- żywiciel pośredni – człowiek.
Ogólny schemat cyklu rozwojowego przedstawicieli rodzaju Plasmodium
powodujących malarię u człowieka jest identyczny, różnice pomiędzy
poszczególnymi gatunkami są niewielkie.
Sporozoity zarodźca dostają się do krwi. Część z nich zostaje zniszczona przez leukocyty,
ale wiele z biegiem krwi dostaje się do wątroby. W ciągu ok. 30 minut
sporozoity znikają z krwi. W komórkach wątroby (hepatocytach) w ciągu
1-3 tygodni przebiega dalsza faza rozwojowa tzn. pozakrwinkowa faza
rozwojowa (schizogonia pozakrwinkowa). Sporozoity zmieniają swój kształt, tworząc formę schizonta. Schizonty dzielą się wielokrotnie, przekształcają się i ostatecznie pękają uwalniając 2-40 tys. merozoitów, które uwalniane są do krwi. Proces ten w zależności od gatunku zarodźca trwa 5-21 dni, lecz w wypadku P. vivax i P. ovale schizogonia pozakrwinkowa może być opóźniona nawet do 1-2 lat – takie "uśpione" formy pierwotniaka nazywane są hypnozoitami. Z tego względu mogą występować późne nawroty malarii. Chociaż zjawisko takie nie występuje w przypadku P. falciparum i P. malariae,
to występuje u nich przewlekła faza choroby we krwi, co powoduje
nawroty w ciągu kilku lat (P. falciparum) lub nawet kilkanaście (P.
malariae).
Merozoity zaczynają atakować czerwone krwinki i w wyniku ich działania dochodzi do rozpadu erytrocytów,
co powoduje wystąpienie objawów chorobowych typowych dla malarii. W
erytrocytach zachodzi albo proces schizogonii krwinkowej, kiedy powstają
w dużej liczbie schizonty lub wytwarzane są stosunkowo nieliczne
gametocyty (rozmnażanie płciowe zarodźca), które z pobieraną krwią mogą
zarażać samice komara z rodzaju Anopheles. W przewodzie pokarmowym samicy komara tworzą one gamety, a po zapłodnieniu zygotę. Zygota
przekształca się w oocystę, w której powstaje do ok. 10 tys.
sporozoitów. Gdy oocysta pęka, sporozoity przemieszczają się do jamy
ciała, a stamtąd do gruczołów ślinowych. Proces powstawania zakaźnych
dla człowieka, inwazyjnych form trwa 2-3 tygodnie.
Cechami wspólnymi tych pierwotniaków są schizogoniczny podział w hepatocytach
(stadia trofozoita i schizonta) oraz w erytrocytach (stadium
pierścienia, schizonta, merozoita) oraz podział gamogoniczny (gamety,
ookineta) i sporogoniczny (sporocysta, sporozoity) w organizmie komara.
Żółta febra (łac. Febris flava) – choroba wywoływana przez wirusa należącego do grupy tzw. flavivirusów.
Infekcja może przebiegać pod różnymi postaciami klinicznymi – od
łagodnych objawów do ciężkiej choroby, kończącej się śmiercią. Słowo
"żółta" w nazwie pochodzi od żółtaczki towarzyszącej części zakażeń.

Epidemiologia
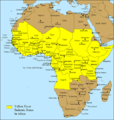
Wirus ten przenoszony jest między innymi przez komary. Występuje w szerokim pasie okołorównikowym w 33 krajach Afryki i w 11 krajach Ameryki Południowej.
W Afryce występują dwa typy wirusów – jeden w Afryce wschodniej, drugi w
zachodniej. Ocenia się, że w Afryce dochodzi do 90% zakażeń żółtą febrą.
W ciągu ostatnich 20 lat na świecie wzrosła liczba epidemii żółtej gorączki, a coraz więcej krajów zgłasza przypadki tej choroby. Szacuje się, że w 2005
r. tylko w 12 krajach afrykańskich zachorowało na nią ok. 206 tys.
osób, z czego 52 tys. zmarło. W Afryce i Ameryce wciąż żyje ogromna
populacja osób niezaszczepionych, a zmiany w środowisku, takie jak
malejąca ilość terenów leśnych, urbanizacja czy rozwój turystyki,
zwiększają ryzyko zetknięcia się z wirusem.
Kraje, w których obowiązkowe jest szczepienie przeciwko żółtej febrze:
- Azja – Jemen;
- Afryka – Benin, Burkina Faso, Etiopia, Ghana, Kamerun, Kongo, Liberia, Mali, Niger, Nigeria, Republika Środkowoafrykańska, Senegal, Togo, Wybrzeże Kości Słoniowej, Demokratyczna Republika Konga, Tanzania;
- Ameryka Południowa – Gujana Francuska, Brazylia (wymagane dla osób przyjeżdżających z krajów dotkniętych tą chorobą).
Rokowanie
Historyczne źródła podawały śmiertelność w przedziale 1 na 17 przypadków (5,8%) i 1 na 3 przypadki (33%). Broszura WHO
na temat żółtej febry zaktualizowana w 2001 podaje, że 15% pacjentów
wchodzi w "fazę toksyczną" i połowa z nich umiera w ciągu 10–14 dni, a
reszta zdrowieje.
Szczepienia w Polsce
W Polsce można się zaszczepić przeciwko żółtej febrze w Wojewódzkich
Stacjach Sanitarno Epidemiologicznych w pracujących przy nich Poradniach
Medycyny Tropikalnej oraz w Instytucie Medycyny Morskiej i Tropikalnej w
Gdyni. Szczepienie potwierdzane jest międzynarodową książeczką zdrowia
(tzw. żółta książeczka), której posiadanie jest warunkiem wjazdu do
części krajów posiadających obowiązek szczepienia. Zarejestrowany w Polsce preparat to żywa, atenuowana szczepionka Stamaril.
Denga' – potencjalnie śmiertelna wirusowa choroba odzwierzęca, przyjmująca postać gorączki krwotocznej występująca u ludzi i niektórych małp. Patogenem odpowiedzialnym za wywołanie choroby są wirusy dengi z rodziny Flaviviridae, przenoszone przez komary z rodzaju Aedes, głównie Aedes albopictus i Aedes aegypti.
Do głównych objawów poza wysoką gorączką należą silne bóle i sztywność
stawów. Występuje endemicznie w strefie subtropikalnej i tropikalnej. Ze
względu na brak szczepionki i skutecznych leków antywirusowych możliwe
jest tylko leczenie objawowe.
Etiologia
Stwierdzono 4 typy serologiczne wirusów denga.
- I - występujący w obu pasach podzwrotnikowych i pasie zwrotnikowym.
- II - występujący w pasie zwrotnikowym
- III - w Indiach, na Filipinach i płd.wsch. Azji
- IV - Indie i Filipiny.
Epidemiologia
Choroba występuje endemicznie w krajach strefy tropikalnej i
subtropikalnej, głównie w Azji, Afryce i na wyspach południowego
Pacyfiku. Pojedyncze przypadki zarażeń u ludzi odnotowano także w
niektórych stanach USA. W Polsce spotyka się przypadki „importowane” z
rejonów endemicznych. Łańcuch epidemiczny stanowią : człowiek lub
niektóre gatunki małp oraz komary z rodzaju Aedes.
Nie dochodzi do zakażeń człowiek-człowiek. W latach 2000-2002 wystąpiły
masowe zachorowania na Filipinach, w Indonezji, w obu Amerykach i na Karaibach.
Patogeneza
Zakażenie wirusami denga przebiega najczęściej bezobjawowo. W
przypadkach klinicznie pełnoobjawowych dochodzi do rozwoju jednej z
trzech postaci: postaci klasycznej, łagodniejszej postaci atypowej lub
najcięższej - gorączki krwotocznej.
Objawy
- nagła gorączka
- silne bóle głowy i stawów
- szybki spadek liczby płytek krwi
- wysypka
- ból gałek ocznych
Rozpoznanie
Rozpoznanie dengi klasycznej jest zazwyczaj trudne poza terenami
endemicznymi. Potwierdzeniem rozpoznania jest izolacja wirusa, a także
zwiększenie stężenia swoistych przeciwciał. Różnicować należy z grypą i
stanami rzekomogrypowymi, zimnicą oraz zespołami toksycznymi.
Leczenie
W klasycznej dendze leczenie jest wyłącznie objawowe. W gorączce
krwotocznej stosuje się leki zapobiegające skazie krwotocznej oraz
leczenie przeciwwstrząsowe.
Zapobieganie
Polega przede wszystkim na zwalczaniu komarów. Opracowywana
atenuowana szczepionka przeciw dendze znajduje się w fazie testów
laboratoryjnych.
Filariozy – grupa, przewlekłych chorób pasożytniczych kręgowców (prócz ryb), które wywołane są przez nicienie, filarie - m.in. Wuchereria bancrofti, Brugia malayi, Onchocerca volvulus i Mansonella ozzardi. Być może w patogenezie choroby odgrywają rolę także endosymbiotyczne pasożyty nicieni - bakterie Wolbachia. Filarioza u człowieka spotykana jest we wschodniej Afryce i Azji. Rejony endemiczne dla filarii zamieszkuje około 1,1 mld ludzi na terenie 76 krajów strefy tropikalnej.
Wektory
Pasożyty są przenoszone przez wiele rodzajów muchówek (komary z rodzajów m.in. Culex i Aedes, meszki).
Podział
- filariozy limfatyczne - spowodowane przez Wuchereria bancrofti, Brugia malayi i Brugia timori
- filariozy skórne - spowodowane przez Onchocerca volvulus, Loa loa, Mansonella perstans, Mansonella ozzardi oraz Mansonella (Dipetalonema) streptocerca
Objawy
Wczesny etap - zapalenie naczyń chłonnych, ból głowy, nudności i pokrzywka; następnie - uszkodzenie układu chłonnego - zapalenie, obrzęk węzłów chłonnych, słoniowacizna kończyn dolnych, górnych, wodniak jądra. Wiele przypadków ma przebieg bezobjawowy.
Rozpoznanie
Grube rozmazy z krwi - badanie mikroskopowe, wykazując mikrofilarie i testy serologiczne.
Leczenie
Lekiem z wyboru jest dietylokarbamazyna.
W 2003 zaproponowano zastosowanie doksycykliny w leczeniu słoniowacizny. Endosymbiotyczne bakterie z rodzaju Wolbachia
są niezbędne do rozwoju larwalnego filarii. Przeprowadzone ostatnio
badania kliniczne sugerują, że do leczenia filariozy wywołanej przez Wuchereria bancrofti można stosować antybiotyk doksycyklinę, który zabija te nicienie.
Zapalenie opon mózgowo-rdzeniowych (łac. meningitis cerebrospinalis purulenta) – choroba wywoływana przez wirusy lub bakterie, rzadziej przez pierwotniaki, pasożyty i niektóre leki, obejmująca opony mózgowo-rdzeniowe.
Epidemiologia
 |
| Demografia meningokokowego zapalenia opon mózgowo-rdzeniowych. Czerwony: pas meningokokowy, pomarańczowy: epidemiczne zapalenie opon mózgowo-rdzeniowych, szary: zachorowania sporadyczne |
Mimo że zapalenie opon mózgowo-rdzeniowych w wielu krajach podlega
obowiązkowemu zgłoszeniu, dokładna wartość zapadalności nie jest znana. W krajach zachodnich
rocznie na bakteryjne zapalenie opon mózgowo-rdzeniowych zapadają 3
osoby na 100 000. Badania całej populacji wykazały, że wirusowe
zapalenie opon mózgowo-rdzeniowych jest najczęstszą postacią i występuje
z częstością 10,9 na 100 000 osób, częściej w lecie. W Brazylii zapadalność
na bakteryjne zapalenie opon mózgowo-rdzeniowych jest wyższa, wynosi
45,8 na 100 000 osób rocznie. W Afryce Subsaharyjskiej duże epidemie
meningokokowego zapalenia opon mózgowo-rdzeniowych występują w okresie
suszy i dlatego nazywa się je "pasem zapalenia opon
mózgowo-rdzeniowych". Roczna zapadalność na tym obszarze, który nie ma
dostatecznej opieki medycznej, wynosi 500 na 100 000 osób. Przypadki te
są głównie spowodowane przez meningokoki.
Ostatnia epidemia, która rozpoczęła się w styczniu 2009 roku objęła
Nigerię, Niger, Mali i Burkinę Faso. Zakażenie meningokokowe występuje w
postaci epidemii w obszarach, gdzie wiele ludzi żyje razem po raz
pierwszy, takich jak koszary wojskowe podczas mobilizacji, miasteczka
studenckie i doroczna pielgrzymka Hadżdż.
Istnieją znaczne różnice w lokalnym rozmieszczeniu drobnoustrojów
wywołujących bakteryjne zapalenie opon mózgowo-rdzeniowych. Na przykład,
N. meningitides grupy B i C powodują większość zachorowań w Europie,
podczas gdy grupa A meningokoków występuje częściej w Chinach i wśród
pielgrzymów Hadżdż. W Afryce przyczyną większości wybuchów epidemii w
"pasie zapalenia opon mózgowo-rdzeniowych" są grupy A i C meningokoków.
Grupa W135 meningokoków spowodowała kilka ostatnich epidemii w Afryce
oraz w trakcie Hadżdż. Oczekuje się, że różnice te będą się zmieniać wraz z wprowadzeniem szczepionek przeciwko najczęstszym szczepom.
Patologia
Zapalenie obejmuje tkanki opon, a często przylegające do nich części mózgowia i rdzenia.
Objawy
Podstawowe objawy to bóle głowy, wymioty i objawy oponowe (sztywność karku, objaw Brudzińskiego).
Mogą też występować: gorączka, senność, śpiączka, podwójne widzenie, zaburzenia mowy, porażenie mięśni, padaczka.
Zapalenie bakteryjne, częściej dotyka dzieci
niż dorosłych, szerzy się drogą kropelkową. Objawy: ból gardła,
gorączka, ból głowy, sztywność karku i wymioty. Na ciele pojawia się
krwistoczerwona wysypka. W ciągu jednego dnia od początku choroby może rozwinąć się ciężki stan, prowadzący do śpiączki i śmierci.
Etiologia
Przyczyny infekcyjne
 |
| Pneumokokowe zapalenie opon mózgowo-rdzeniowych, treść ropna w przestrzeni podpajeczynówkowej |
- wirusy – najczęstsza przyczyna
- enterowirusy
- wirusy ECHO
- HSV-2
- arbowirusy (dają meningoencephalitis)
- Coxsackie
- VZV
- Wirus Epsteina-Barr (rzadko)
- wirus polio
- wirusy grypy A i B
- wirus odry
- bakterie
| Grupa wiekowa | Przyczyny |
|---|---|
| Noworodki | Streptokoki grupy B, Escherichia coli, Listeria monocytogenes |
| Niemowlęta | Neisseria meningitidis, Haemophilus influenzae, Streptococcus pneumoniae |
| Dzieci | N. meningitidis, S. pneumoniae |
| Dorośli | S. pneumoniae, N. meningitidis, Mycobacteria, kryptokoki |
- najczęściej:
- Neisseria meningitidis (dwoinka zapalenia opon mózgowo-rdzeniowych),
- Streptococcus pneumoniae (pneumokoki),
- Haemophilus influenzae typ B;
- rzadziej:
- Listeria monocytogenes,
- choroba z Lyme (Borrelia burgdorferi),
- Staphylococcus, Escherichia coli;
- w krajach rozwijających się częstą przyczyną są prątki gruźlicy (Mycobacterium tuberculosis);
- Streptococcus agalactiae sive pyogenes jest ważną przyczyną zapalenia opon mózgowo-rdzeniowych u noworodków, cechuje się wysoką śmiertelnością.
- grzyby, np. Cryptococcus neoformans, Coccidioides immitis.
Zapalenie opon mózgowo-rdzeniowych ropne, bakteryjne, jest zawsze wtórne do ogniska infekcji poza układem nerwowym:
- ropnego zapalenia ucha środkowego – Streptococcus pneumoniae, Haemophilus influenzae,
- ropnego zapalenia zatok – Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus,
- odoskrzelowego zapalenia płuc – Streptococcus pneumoniae,
- zmian ropnych na skórze – Staphylococcus aureus,
- ropni przywierzchołkowych zębów – Staphylococcus aureus, flora beztlenowa,
- zakażenia dróg moczowych – Escherichia coli, Proteus mirabilis, flora beztlenowa,
- zakażenia dróg żółciowych – Escherichia coli, Proteus mirabilis,
- ogniska w jamie brzusznej – zakażenia mieszane: flora beztlenowa, pałeczki tlenowe G-.
Przyczyny nieinfekcyjne
- nowotwory:
- białaczka,
- nowotwory tkanki limfatycznej,
- guzy mózgu,
- przerzuty do mózgu,
- sarkoidoza,
- leki, np. metotreksat,
- zatrucie ołowiem.
Diagnoza
Zmiany w płynie mózgowo-rdzeniowym zależą od rodzaju zapalenia opon mózgowo-rdzeniowych.
| Stan | barwa | przejrzystość | liczba komórek w μl (cytoza) | neutrofile (%) | limfocyty (%) | stężenie białka (mg/dl) | stężenie glukozy (% stężenia w surowicy) | stężenie chloru (mmol/l) | stężenie kwasu mlekowego (mmol/l) |
|---|---|---|---|---|---|---|---|---|---|
| prawidłowy | wodojasny | klarowny | ≤5 | 0 | 100 | 15-45 | 60-75% | >117 | <2,1 |
| ropne ZOMR | żółtawy | mętny | od kilku do całego pola widzenia | ↑↑↑ 95 - 100 | - | ↑ >200 | ↓ <40% | ↓↓ | ↑ >3,5 |
| gruźlicze ZOMR | wodojasny lub opalizujący | klarowny | kilkadziesiąt do 1000 | ↑ 0-25 | >75 | ↑ zwykle ~ 100 | ↓ 10-30% | często ↓↓↓ | ↑↑↑ |
| wirusowe ZOMR | wodojasny | klarowny | kilka do kilkuset | ↑ 0-25 | >75 | norma lub ↑ (<200) | norma lub ↓ | norma lub ↓ | norma lub ↑ (2,2-3) |
| grzybicze ZOMR | wodojasny, opalizujący; niekiedy ropny | klarowny lub mętny | kilka do kilkuset | ↑ | ↓ | ||||
| nowotworowe ZOMR | ↑ | ↑ | ↑ | ↓ |
Leczenie
- przeciwwirusowo: leczenie objawowe, ogólnie podtrzymujące, w skrajnie ciężkich przypadkach gancyklowir i interferon
- przeciwbakteryjnie: antybiotyki, np. ampicylina, aminoglikozydy, cefalosporyny III generacji (np. ceftriakson, ceftazydym)
- przeciwgruźliczo: streptomycyna, pirazynamid, rifampicyna, izoniazyd, etambutol
- przeciwgrzybiczo: amfoterycyna B, flukonazol
Immunoprofilaktyka
Istnieją szczepionki przeciwko:
- meningokokom
- Haemophilus influenzae typ B
- pneumokokom
- wirusowi kleszczowego zapalenia opon mózgowych
U niemowląt szczepienia przeciwko wirusowej odmianie meningitis
stosowane są jedynie w: Irlandii, Wielkiej Brytanii, Hiszpanii i na
Kubie. W innych krajach (w tym Polsce) szczepionki takiej nie stosuje
się.
Zapobieganie
Niektórym przyczynom zapalenia opon mózgowo-rdzeniowych można
zapobiegać poprzez stosowanie profilaktyki długoterminowej w postaci
szczepionki lub krótkoterminowej w postaci antybiotyków.
Od 1980 wiele krajów uwzględniło szczepienie przeciwko Haemophilus influenzae
typu B w kalendarzach rutynowych szczepień dzieci. Dzięki temu w tych
krajach praktycznie wyeliminowano tę bakterię jako przyczynę zapalenia
opon mózgowo-rdzeniowych wśród małych dzieci. Jednak w krajach, w
których obciążenie chorobą jest najwyższe, szczepionka jest nadal zbyt
droga.
Podobnie, szczepienie przeciwko wirusowi świnki doprowadziło do
gwałtownego spadku liczby przypadków zapalenia opon mózgowo-rdzeniowych
spowodowanych wirusem świnki, które występowało w 15% przypadków tej
choroby.
Istnieją szczepionki przeciwko meningokokom grupy A, C, W135 i Y.
W krajach, gdzie wprowadzono szczepionkę przeciwko meningokokom grupy
C, znacząco spadła liczba przypadków spowodowanych przez ten patogen.
Obecnie istnieje szczepionka poliwalentna łącząca wszystkie cztery
szczepionki. Szczepienie szczepionką ACW135Y przeciwko czterem szczepom
jest obecnie obowiązkowa dla biorących udział w Hadżdż.
Opracowanie szczepionki przeciwko grupie B meningokoków okazało się
znacznie trudniejsze, ponieważ ich białka powierzchowne (które zwykle są
wykorzystywane do wytwarzania szczepionki) wywołują słabą odpowiedź ze
strony układu odpornościowego lub reakcję krzyżową z białkami ludzkimi. Jednak, w niektórych krajach (np. Nowej Zelandii, Kubie, Norwegii i Chile)
opracowano szczepionki przeciwko miejscowym szczepom grupy B
meningokoków. Niektóre z nich wykazały się dobrą skutecznością i są
stosowane w miejscowych kalendarzach szczepień.
Rutynowe szczepienia przeciwko Streptococcus pneumoniae
skoniugowaną szczepionką przeciwko pneumokokom (PCV), która jest aktywna
wobec siedmiu serotypów tego patogenu, znacząco zmniejsza częstość
występowania pneumokokowego zapalenia opon mózgowo-rdzeniowych.
Szczepionka z otoczek polisacharydowych obejmująca 23 szczepy jest
podawana tylko niektórym grupom (np. osobom, u których wykonanko
splenektomię, czyli chirurgiczne usunięcie śledziony), nie wywołuje ona
wystarczająco silnej odpowiedzi immunologicznej u wszystkich
przyjmujących, np. małych dzieci.
Szczepienie w dzieciństwie szczepionką BCG spowodowało znaczne
zmniejszenie zapadalności na gruźlicze zapalenie opon
mózgowo-rdzeniowych, ale jego zmniejszająca się skuteczność w dorosłym
wieku skłoniła do poszukiwania lepszej szczepionki.
Krótkoterminowa profilaktyka antybiotykowa jest również metodą
zapobiegania, szczególnie meningokokowego zapalenia opon
mózgowo-rdzeniowych. W przypadku bliskiego kontaktu z chorym na
meningokokowe zapalenie opon mózgowo-rdzeniowych, zapobieganie
antybiotykami (np. ryfampicyną, cyprofloksacyną, ceftriaksonem) może zmniejszyć ryzyko zarażenia się chorobą, ale nie chroni przed zakażeniami w przyszłości.
 |
Historia
Niektórzy sugerują, że Hipokrates mógł mieć świadomość istnienia zapalenia opon mózgowo-rdzeniowych i wydaje się, że zapalenie opon mózgowo-rdzeniowych znali też inni przedrenesansowi lekarze, tacy jak Awicenna.
Opis gruźliczego zapalenia opon mózgowo-rdzeniowych, zwanego ówcześnie
"puchliną mózgu", jest często przypisywany lekarzowi z Edynburga,
Robertowi Whyttowi, w pośmiertnym doniesieniu, które ukazało się w roku
1768, chociaż związek gruźlicy z jej patogenem nie był znany aż do
następnego stulecia. Wydaje się, że epidemia zapalenia opon mózgowo-rdzeniowych jest zjawiskiem stosunkowo niedawnym.
Pierwsze odnotowane poważne ogniska pojawiły się w Genewie w roku 1805.
Krótko po tym opisano kilka innych epidemii w Europie i Stanach
Zjednoczonych, a pierwsze doniesienie o epidemii w Afryce pojawiło się w
roku 1840. Epidemie w Afryce rozpowszechniły się w dwudziestym wieku,
począwszy od poważnych epidemii ogarniających Nigerię i Ghanę w latach
1905–1908.
Pierwsze doniesienie o zakażeniach bakteryjnych stanowiących podłoże
dla zapalenia opon mózgowo-rdzeniowych zostało podane przez
austriackiego bakteriologa Antona Weichselbauma, który w roku 1887
opisał meningokoki.
We wczesnych doniesieniach śmiertelność z powodu zapalenia opon
mózgowo-rdzeniowych była bardzo wysoka (ponad 90%). W roku 1906 została
wyprodukowana końska surowica odpornościowa. Następnie była udoskonalana
przez amerykańskiego naukowca Simona Flexnera, co znacznie zmniejszyło
śmiertelność z powodu chorób spowodowanych przez meningokoki. W roku 1944, po raz pierwszy odnotowano skuteczność penicyliny w leczeniu zapalenia opon mózgowo-rdzeniowych.
Wprowadzenie pod koniec dwudziestego wieku szczepionki przeciwko
Haemophilus doprowadziła do wyraźnego spadku zapalenia opon
mózgowo-rdzeniowych związanego z tym patogenem[8,
a w roku 2002 pojawiły się dowody, że leczenie sterydami może poprawić
rokowanie w bakteryjnym zapaleniu opon mózgowo-rdzeniowych
Gorączka doliny Rift
| Gorączka doliny Rift | |||
|
|||
Gorączka doliny Rift (RVF, wet. enzootyczne zapalenie wątroby) – choroba zakaźna owiec, bydła i ludzi występująca w Afryce (włączając Madagaskar), Arabii Saudyjskiej i Jemenie, zaliczana do grupy gorączek krwotocznych. Choroba występuje endemicznie w Kenii, Malawi, Tanzanii i Zimbabwe.
Etiologia
 |
| Mikrofotografia z elektronowego mikroskopu transmisyjnego ukazująca tkankę zainfekowaną wirusem Rift Valley |
Czynnikiem etiologicznym choroby jest RNA-wirus RVW należący do rodzaju Phlebovirus rodziny Bunyaviridae. Wirusa udało się wyizolować od blisko 30 gatunków komarów, zaliczanych do 6 rodzajów, a także od much Culicoides i Simulium. Duża część z nich może przenosić wirusy na zwierzęta domowe.
Istnieje pogląd, że we wschodniej Afryce, RVW utrzymuje się na obszarach o wysokiej wilgotności w cyklu enzootycznym. Wyjątkowo obfite opady deszczów tworzą warunki dogodne dla wylęgu jaj komarów z rodzaju Aedes, które następnie żerują na zwierzętach hodowlanych. Zainfekowane komary przenoszą wirusy na kręgowce, które stają się wtórnym źródłem zakażeń.
Pomimo że wirus został wyizolowany z mleka
eksperymentalnie zakażonej krowy, nie ma dowodów na możliwość zakażenia
drogą pokarmową. Uważa się natomiast, iż możliwa jest transmisja drogą
wziewną, w wyniku inhalacji aerosolu zawierającego krew chorych zwierząt (dotyczy pracowników rzeźni, weterynarzy i personelu laboratoryjnego).
Epidemiologiczna i geograficzna charakterystyka RVF
Od roku 1931, kiedy wirus został wyizolowany od owcy w dolinie Rift w Kenii, kilkukrotnie, w nieregularnych odstępach czasu dochodziło do epizootii. Najpoważniejszy był epizod w Republice Południowej Afryki latem 1950-1951,
podczas którego padło około 100 tys. sztuk owiec i bydła, a także
wystąpiło 20 tys. zachorowań u ludzi. W tym samym rejonie ograniczone
wybuchy występowały też u ludzi i zwierząt w latach 1953, 1956 i 1969.
W latach 1974-1976 obserwowano kolejny znaczy wzrost zachorowań u zwierząt domowych i ludzi na tym terenie (odnotowano co najmniej cztery zgony). Podobną naprzemienność pomiędzy okresami enzootii i epizootii obserwowano także w innych krajach Afryki Południowej i Wschodniej.
Najbardziej znaczące epizootie w Republice Południowej Afryki i Zimbabwe wystąpiły na obszarach płaskowyżów,
które nie są uważane za naturalne środowisko występowania wirusa.
Przypisuje się je pojawieniu się wciąż niezidentyfikowanego czynnika
(prawdopodobnie komary z rodziny Aedes) pochodzącego z obszaru enzootycznego.
Aż do 1977 choroba ograniczona była do krajów na południe od Sahary. W tym roku gorączka doliny Rift wybuchła w alarmującej skali w Egipcie, powodując co najmniej 20 tys. przypadków u ludzi, w tym około 600 zgonów. W kolejnym roku wystąpiło następne 400 przypadków. Śmiertelność oceniano na 3%. Obecność przeciwciał,
zależnie od regionu stwierdzano od poniżej 1% do 25% ludzi.
Zainfekowane było 1 milion osób. Wystąpienie RVF w Egipcie było wielce
niespodziewane - region ekologiczny znacznie odbiegał od tego, na jakim
choroba występowała w przeszłości, przebieg zakażenia był dużo cięższy,
notowano znacznie wyższą chorobowość i śmiertelność. Nie wiadomo w jaki sposób choroba dotarła do Egiptu. Przypuszcza się, iż pochodziła z Sudanu gdzie do epizootii doszło w 1976, a wirus został przeniesiony przez ludzi lub wielbłądy, u których występowała wiremia, albo przez niesione wiatrem stawonogi.
W 1987 roku gorączka pojawiła się w Mauretanii w okolicach miasta Rosso nad rzeką Senegal, skąd dotarła do oddalonych o 88 km obozów nomadów. Według obliczeń Instytutu Pasteura w Dakarze
wśród ludzi wystąpiły 1264 zachorowania, spośród których 224 okazały
się śmiertelne. Potwierdzono także, że w zachodniej Afryce dochodziło do
aktywnej transmisji wirusa u owiec w latach 1989-1991 (Wybrzeże Kości Słoniowej). Wirusa izolowano w tej części kontynentu od Culex poicilipes, Aedes ochraceus, Aedes dalzieli i Aedes vexans.
W 1993 choroba ponownie pojawiła się w Egipcie, w gubernatorstwie Asuan. Doszło do około 6 tys. infekcji u ludzi (potwierdzonych serologicznie), u 41 osób obserwowano, mało typowe dla RVF, objawy oftalmologiczne. Zakażenia obserwowano też w delcie Nilu. Za transmisję wirusa miały odpowiadać Aedes caspius, Culex perexiguus i Culex pipiens, podczas gdy w 1977 za główny wektory uważano Culex theileri i Aedes caballus.
W tym samym roku wystąpiły także masowe przypadki zachorowań w Zambii i Zimbabwe, a w 1998 w Kenii, Mauretanii i Somalii.
W 2000 roku chorobę opisano poza Afryką - w Jemenie (ponad tysiąc podejrzeń choroby, 121 zgonów) i Arabii Saudyjskiej (882 potwierdzone przypadki, 124 zgony).
Objawy i przebieg u ludzi
Na obszarach subsaharyjskich zakażenie RVW przebiega zwykle łagodnie a
powikłania są rzadkie. Po okresie inkubacji wynoszącym 4-6 dni pojawia
się gorączka, intensywne bóle głowy, bóle mięśni i stawów, światłowstręt, czasem zawroty głowy, nudności, wymioty, osłabienie, halucynacje. Choroba trwa kilka dni, ale gorączka może nawrócić. Większość pacjentów wraca do pełni zdrowia.
Najczęstszym powikłaniem jest wirusowe uszkodzenie siatkówki, w tym plamki żółtej. Dochodzi do, często utrwalonych, ubytków widzenia centralnego.
W najcięższej postaci dochodzi do wystąpienia objawów krwotocznych i zapalenia opon mózgowo-rdzeniowych. Po kilku dniach gorączki pojawiają się żółtaczka, krwiste wymioty i smoliste stolce, krwawienia z dziąseł oraz petechiae. Objawy oponowe występują 5 do 15 dni po okresie gorączkowym. W badaniu sekcyjnym stwierdza się ogniska martwicze w wątrobie.
Rozpoznanie
Potwierdzenie rozpoznania choroby uzyskuje się poprzez izolację wirusa z próbki krwi podczas ostrej fazy choroby (dootrzewnowa inokulacja dorosłych myszy lub chomików powoduje padanie zwierząt w ciągu 2-3 dni). Można wykonać test neutralizacji, odczyn wiązania dopełniacza i immunofluorescencji pośredniej. Szczególnie użyteczny jest test ELISA, ponieważ pozwala wykryć przeciwciała klasy IgM. Także reakcja rt-PCR umożliwia rozpoznanie we wczesnej fazie u zwierząt i ludzi.
Rozpoznanie u zwierząt może być oparte na badaniu histopatologicznym
wycinka pobranego z wątroby, w której w przypadku choroby dochodzi do patognomonicznych zmian - obecności martwicy i kwasochłonnych wtrętów wewnątrzjądrowych.
Diagnostyka różnicowa powinna obejmować zarażenie wirusem Wesselsbron, które cechuje się podobnymi objawami i epidemiologią.
Leczenie
W przypadkach postaci niepowikłanej najczęściej wystarcza leczenie
objawowe. W ciężkich przypadkach uzasadnione może być dożylne podawanie rybawiryny, której skuteczność wykazano u myszy, kotów i małp. Uważa się także za korzystne podawanie immunizowanego osocza i terapię interferonem.
Zapobieganie
Nieprzewidywalna natura epidemii czyni trudnym stworzenie
systematycznej profilaktyki przeciwko RVF u zwierząt. Najlepszym
rozwiązaniem jest ich szczepienie.
Uważa się, że poprzez immunizację udomowionych zwierząt można uniknąć
epizootii i epidemii spowodowanych wirusami pochodzącymi z krajów
ościennych. Przykładem może być akcja wakcynacji bydła i owiec
przeprowadzono w 1978 roku w Izraelu, który uniknął choroby trzebiącej hodowle Egipcie.
Od wielu lat stosowane są szczepionki inaktywowane i atenuowane.
Szczepionka zawierająca żywego, atenuowanego wirusa, niezalecana jest jednak na obszarach wolnych od wirusa (możliwość mutacji do formy zjadliwej).
Ze względu na niski koszt i łatwość przygotowania, wykorzystywano ją w
epizootiach w RPA i Kenii. Szczepionka atenuowana zapewnia krótkotrwałą
ochronę i wymaga okresowego doszczepiania, ponadto czas od szczepienia,
potrzebny do wytworzenia odpowiedniej ochrony, wynosi 1-2 tygodnie.






Brak komentarzy:
Prześlij komentarz